用于细胞膜片组织工程的基于聚N-异丙基丙烯酰胺的智能表面
简介
组织工程已成为治疗受损或患病的器官和组织(例如血管和尿囊)的关键治疗工具。1尽管如此,仍然还存在许多主要的挑战需要克服,特别是在构建具有高细胞密度的组织和移植后炎症预防方面。一种有前景的组织工程方法依赖于使用聚N-异丙基丙烯酰胺(PNIPAM)接枝的细胞培养表面。2 其基本思想是通过简单的温度调控来实现PNIPAM改性基底上的细胞粘附/分离(图1)。
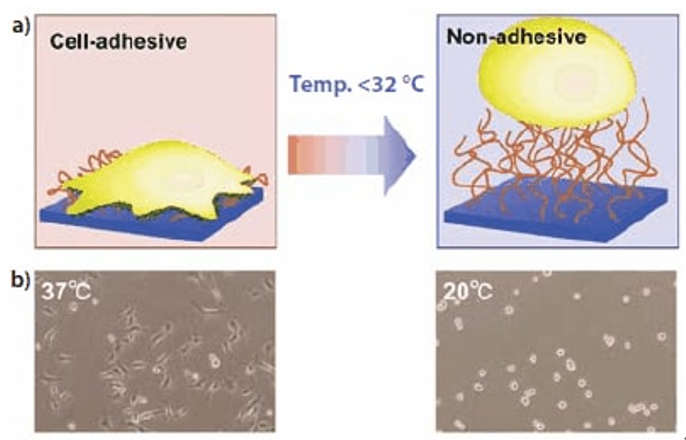
图 1.(a)细胞在聚N-异丙基丙烯酰胺接枝表面上的粘附(37℃)和脱离(20℃)示意图。通过降低温度可简单地实现细胞收集。(b)在37℃和20℃下PNIPAM包被的培养皿上内皮细胞的显微照片。注意:左侧显微照片中的细长形状细胞表示在支持物上的细胞培养,而右侧照片中的圆形细胞表示在溶液中的游离细胞。
达到融合后,通过简单地将细胞培养温度从37℃降低至20℃,培养的细胞便可以以组织样细胞单层或“细胞膜片”的形式从“智能”PNIPAM表面进行收集。这种细胞操作技术能够在不使用可生物降解的聚合物支架的情况下将细胞膜片移植到宿主组织中,从而克服了传统组织工程的主要限制。本文介绍了这一过程的化学基础,首先我们对PNIPAM在水溶液中的性质进行了简要的回顾。我们着重对用于获得多功能细胞膜片的改性表面的设计和制造过程进行了介绍。
聚N-异丙基丙烯酰胺:无处不在的“智能”聚合物
PNIPAM可溶于有机溶剂,如氯仿、丙酮、甲醇和各种其他醇类。只要溶液保持在一定的冷却环境,其便可溶于水。将PNIPAM水溶液加热至32℃(浊点(CP)或较低临界溶解温度(LCST)),可立即将澄清溶液转化为乳状悬浮液。这种现象是可逆的:一旦乳状悬浮液冷却到32℃以下,它就会恢复澄清。3在20世纪60年代后期,Heskins和Guillet发表了水/ PNIPAM系统的第一个相图,该相图是通过测定相变温度作为PNIPAM浓度的函数来构建的。4大约在同一时间,人们发现交联的PNIPAM网络(凝胶)在水中也表现出奇特的性质:它们在冷水中高度溶胀,但一旦加热到32℃以上就会收缩。与PNIPAM溶液的情况一样,凝胶的行为是可逆的,一旦冷却到32℃以下就会膨胀回原来的体积。通过凝胶进行数百次膨胀/收缩循环,没有发现材料疲劳的迹象。Allan S. Hoffmann注意到这种不同寻常的现象,他是第一批使用PNIPAM衍生物的温度诱导相变性质的人,他将这些衍生物作为控制与生物医学应用相关现象的触发器,例如染料或药物的释放。5这项开创性工作奠定了响应系统领域的基础,该系统持续吸引着科学家的想象力。6 由于许多其他水溶性聚合物也具有浊点,所以PNIPAM水溶液显示出的热诱导相变并不是唯一的。然而,由于其相变的清晰度、接近体温的相变温度、聚合物本身的稳健性、以及关于聚合物本身和相变信息的可用性,使得PNIPAM仍然是生物医学应用的首选。
在分子水平上,宏观相变对应于PNIPAM链的脱水和随后的裸露疏水链塌陷成致密小球,进而聚集成较大中间小球(图2)。7,8然而,相变不仅仅取决于温度诱导的分子重排。虽然效果并不总是可预测,但其他几个因素也可能影响PNIPAM的CP。

图 2.聚N-异丙基丙烯酰胺(PNIPAM)水溶液的温度响应特性; (a)当加热到LCST以上时,水合延长的PNIPAM链塌陷成疏水小球,同时释放结合的水分子; (b)PNIPAM重复单元的化学结构; (c)PNIPAM水溶液中溶液透射率随温度变化的曲线图。LCST为相变曲线的中点。
分子量
聚合物分子量对浊点的影响程度已经得到了广泛的讨论。有一些报道表明PNIPAM在水中的浊点与分子量直接相关,而另一些则报道了CP对分子量的逆相关性,还有一些则报道了PNIPAM水溶液的CP与分子量无关。当比较相对短的聚合物链(M w <20,000 g/L)的结果时,其差异特别显著,其原因是链端的化学性质对CP值有显著影响。9具有亲水端基的聚合物倾向于在低浓度溶液中表现出相对高的浊点,而具有疏水端基的聚合物在相同条件下通常具有较低的CP。10 这些趋势对于具有强疏水性端基的PNIPAM溶液确又不适用,例如正十八烷基链,其在水中能自组装形成花和星形胶束。11,12
溶剂系统
多溶剂系统的存在也会对PNIPAM的CP产生影响。例如,在室温下,PNIPAM在一系列组成情况下都不溶于水/甲醇混合溶液 - 表现出称为共同非溶剂的现象。13
盐的存在
盐的存在也会影响PNIPAM水溶液的CP,一些盐会导致CP增加,而添加其他盐又可能会导致CP降低。目前已经有几种解释可以来说明这些观察结果。14一旦完全理解了影响PNIPAM相变的因素,就可以使用它们来定制和优化PNIPAM以用于进一步的应用。然而,人们已经发现了这种智能聚合物的令人兴奋的用途。
用于细胞膜片工程的温度响应细胞培养皿
PNIPAM包被的细胞培养皿是通过电子束照射(0.3MGy,150kV)NIPAM单体进行制备,将溶于2-丙醇中的NIPAM溶液固定在市售的组织培养聚苯乙烯(TCPS)细胞培养皿上(图3)。该处理使得NIPAM的聚合和在TCPS表面上进行聚合物链的共价接枝过程同时进行。该方法干净、易于按比例放大和图案化,并且可以精确控制聚合物层的厚度。对于大多数细胞培养应用来说,接枝PNIPAM层的厚度应在15-20nm范围内,这相当于接枝密度为1.4–2.0 μg/cm 2。15
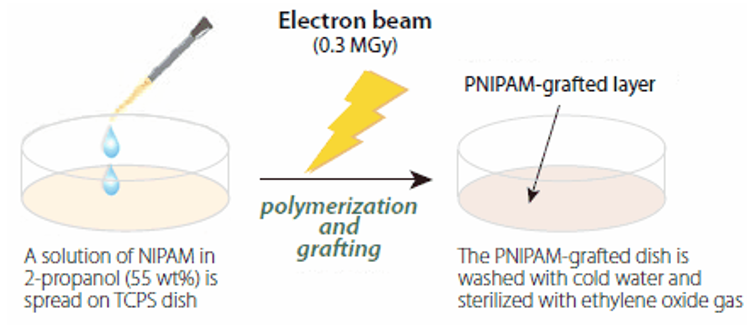
图 3.聚N-异丙基丙烯酰胺接枝细胞培养皿的制备步骤示意图。
在与普通TCPS培养皿类似的培养条件下,不同种的细胞类型可以在温度响应性PNIPAM培养表面上粘附和生长。在37℃达到细胞汇合后,将培养皿冷却至32℃以下(通常至20℃)。聚合物链再次水合并排斥细胞,从而诱导细胞以由连续的单层细胞组成的细胞片的形式从培养表面上剥离。在常规的基于细胞的组织工程中,通常将蛋白水解酶(例如,胰蛋白酶和分散酶)添加至培养基中,从而通过破坏细胞粘附分子和细胞外基质(ECM)蛋白来分离细胞。这一处理还可能影响到对各种不同细胞类型来说具有独特重要功能的细胞膜蛋白。在温度响应性表面上培养的细胞则不需要酶处理来收集。因此,仍然具有其基础ECM蛋白的回收细胞膜片可以转移到新培养皿、其他细胞膜片上或活组织中。目前几个细胞膜片组织工程临床试验正在使用单细胞膜片进行移植,例如角膜和牙周韧带。正在进行的研究包括多个细胞膜片的同型和异型分层,以创建3D组织样结构,如心脏或肝脏组织。16
用于异型细胞共培养的图案化温度响应表面
为了模拟特定的组织功能,有必要再生出具有异型细胞-细胞相互作用的空间有序组织结构。由于不同细胞类型的粘附和增殖特性通常不尽相同,因此在单个3D组织结构中整合多种细胞类型并非易事。在大多数情况下,不同细胞类型的共培养在微图案化表面上进行。由于PNIPAM的LCST也可以通过掺入共聚单体来调节,因此可以根据这一点容易制造出温度响应的微图案化表面。具有亲水共聚单体的NIPAM共聚物LCST> 32℃的,而掺入疏水性单体,例如甲基丙烯酸正丁酯(BMA),的NIPAM共聚物,其LCST <32℃。为了制备微图案化表面,可将溶于2-丙醇中的BMA分散在PNIPAM接枝的TCPS培养皿上。随后,通过不锈钢微图案掩模用电子束照射BMA涂覆的表面。17 BMA单体则会被接枝到照射区域中的预成型PNIPAM层上,而在掩蔽部分则保留了原始PNIPAM。照射区域的相变温度则会低于32℃。因而可以通过控制BMA的掺入水平来调节实际的LCST值。 图4描述了将该图案化方法应用于肝细胞(HC)和内皮细胞(EC)的共培养中。
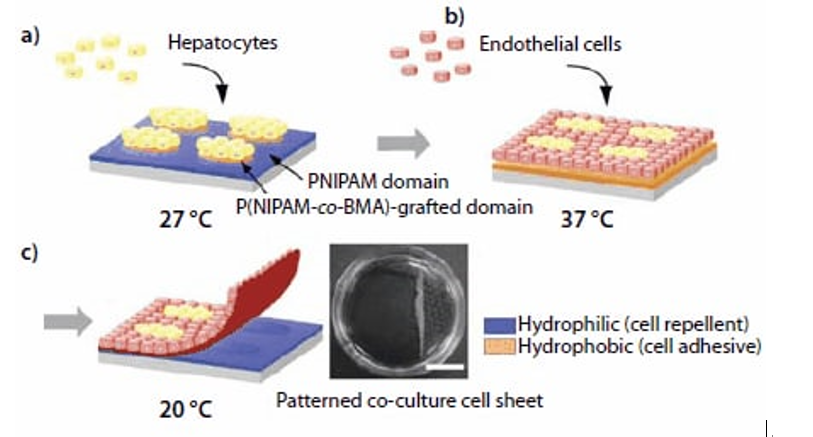
图 4.图案化细胞共培养和使用图案化温度响应表面收集共培养细胞膜片的示意图。(a)将肝细胞(HC)接种并在27℃下培养,结果导致HC定位于表现出疏水性的P(NIPAM-co-BMA)接枝岛上。(b)接种内皮细胞(EC)并在37℃下培养,从而获得图案化的共培养物。(c)将温度降低至20℃诱导共培养细胞膜片的分离。收集的图案化共培养细胞膜片(右;比例尺:1厘米)。
首先,将HCs接种在保持在27℃的微图案界面上。它们完全粘附在P(NIPAM-co-BMA)结构区域上,该区域在该温度下是脱水(疏水)的。PNIPAM结构区域在27℃是水合(亲水)的,因而排斥细胞(图4a)。接下来,将HC涂覆的界面加热至37℃。PNIPAM结构区域因而变得疏水并且用于EC的接种。EC粘附至PNIPAM区域并进行增殖,(图4b和4C)。然后,将培养温度降至20℃,从而触发整个表面的水合作用。共培养的细胞单层自发分离,从而产生具有异型细胞相互作用的连续细胞膜片。回收的共培养细胞膜片可以被操作并夹在其他细胞片之间,用于制备组织模拟多层材料。
温度响应培养皿的功能化
化学反应性(功能性)共聚单体可以掺入接枝的PNIPAM层中,并作为引入生物活性分子的位点,如图5所示。15
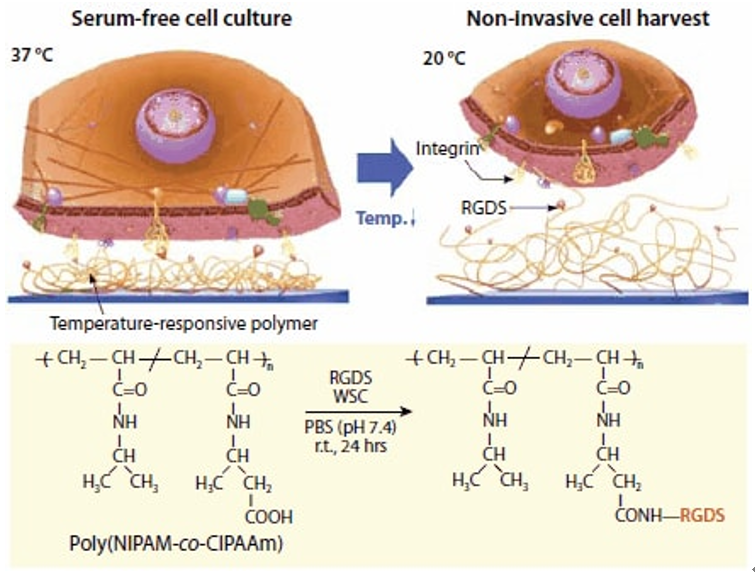
图 5.整联蛋白受体和RGDS(Arg-Gly-Asp-Ser)肽之间的温度响应亲和力控制示意图。通过形成酰胺键,RGDS配体与P(NIPAM-co-CIPAAm)偶联,其中使用 N-(3-二甲基氨基丙基)- N′-乙基碳二亚胺盐酸盐(水溶性碳二亚胺(WSC,产品编号E1769)作为偶联剂。在37℃时,温度响应性聚合物收缩以使RGDS配体(红色珠子)暴露于细胞膜整联蛋白受体(黄色)。因此,可以在固定有RGDS的温度响应培养皿上,在无血清条件下进行细胞培养。并且,通过将培养温度降低至20℃,可以实现非侵入性地将细胞进行收集。RGDS配体会保持附着于温度响应性聚合物表面。
首先,通过电子束将NIPAM和2-羧基异丙基丙烯酰胺(CIPAAm)的混合物聚合成NIPAM / CIPAAm混共聚物,并接枝至TCPS培养皿上(CIPAAm含量:1-5mol%)。随后,使用标准的酰胺键形成方法,将合成的细胞粘附四肽,Arg-Gly-Asp-Ser(RGDS,产品编号A9041共价连接至接枝有PCH(NIPAM-co-CIPAAm)的TCPS培养皿上。18在补充有重组生长因子的无血清培养条件下,该界面上存在的RGDS在37℃下可促进细胞粘附和细胞生长至融合。在达到融合后,只需简单地将温度降低至20℃,便可以像PNIPAM接枝培养皿的情况一样,将细胞以完整的细胞膜片形式进行收集。PNIPAM表面链的再水合会不可逆地破坏表面固定的RGDS肽与细胞膜整联蛋白受体之间的相互作用。该策略显著缩短了培养时间,并使研究人员可以在没有传统胎牛血清的情况下进行细胞生长,这是一个重要的考虑因素,因为在应用于临床人体细胞疗法的组织制造中使用哺乳动物来源的产品可能存在相关的风险。
结论
温度响应细胞膜片工程的未来发展取决于是否能够获得精确优化的PNIPAM接枝表面,从而用以控制异型细胞膜片的制造。一种有前景的方法依赖于使用厚度和接枝密度可控的PNIPAM刷(通过受控游离基聚合来制备,例如原子转移自由基聚合(ATRP)和可逆加成-断裂链转移(RAFT)聚合)。19-21 这些新型智能表面的开发及其研究以及其医疗用途将开辟生物和医学领域的新领域。
参考文献
1.Vacanti CA. 2001. The Impact of Biomaterials Research on Tissue Engineering. MRS Bull.. 26(10):798-799. http://dx.doi.org/10.1557/mrs2001.207
2.Yamada N, Okano T, Sakai H, Karikusa F, Sawasaki Y, Sakurai Y. 1990. Makromol. Chem., Rapid Commun.. 11(11):571-576. http://dx.doi.org/10.1002/marc.1990.030111109
3.Schild H. 1992. Poly(N-isopropylacrylamide): experiment, theory and application. Progress in Polymer Science. 17(2):163-249. http://dx.doi.org/10.1016/0079-6700(92)90023-r
4.Heskins M, Guillet JE. 1968. Solution Properties of Poly(N-isopropylacrylamide). Journal of Macromolecular Science: Part A - Chemistry. 2(8):1441-1455. http://dx.doi.org/10.1080/10601326808051910
5.Ding Z, Chen G, Hoffman AS. 1996. Synthesis and Purification of Thermally Sensitive Oligomer?Enzyme Conjugates of Poly(N-isopropylacrylamide)?Trypsin. Bioconjugate Chem.. 7(1):121-125. http://dx.doi.org/10.1021/bc950087r
6.Stuart MAC, Huck WTS, Genzer J, Müller M, Ober C, Stamm M, Sukhorukov GB, Szleifer I, Tsukruk VV, Urban M, et al. 2010. Emerging applications of stimuli-responsive polymer materials. Nature Mater. 9(2):101-113. http://dx.doi.org/10.1038/nmat2614
7.Okada Y, Tanaka F. 2005. Cooperative Hydration, Chain Collapse, and Flat LCST Behavior in Aqueous Poly(N-isopropylacrylamide) Solutions. Macromolecules. 38(10):4465-4471. http://dx.doi.org/10.1021/ma0502497
8.Kujawa P, Aseyev V, Tenhu H, Winnik FM. 2006. Temperature-Sensitive Properties of Poly(N-isopropylacrylamide) Mesoglobules Formed in Dilute Aqueous Solutions Heated above Their Demixing Point. Macromolecules. 39(22):7686-7693. http://dx.doi.org/10.1021/ma061604b
9.Xia Y, Burke NAD, Stöver HDH. 2006. End Group Effect on the Thermal Response of Narrow-Disperse Poly(N-isopropylacrylamide) Prepared by Atom Transfer Radical Polymerization. Macromolecules. 39(6):2275-2283. http://dx.doi.org/10.1021/ma0519617
10.Duan Q, Miura Y, Narumi A, Shen X, Sato S, Satoh T, Kakuchi T. 2006. Synthesis and thermoresponsive property of end-functionalized poly(N-isopropylacrylamide) with pyrenyl group. J. Polym. Sci. A Polym. Chem.. 44(3):1117-1124. http://dx.doi.org/10.1002/pola.21208
11.Kujawa P, Segui F, Shaban S, Diab C, Okada Y, Tanaka F, Winnik FM. 2006. Impact of End-Group Association and Main-Chain Hydration on the Thermosensitive Properties of Hydrophobically Modified Telechelic Poly(N-isopropylacrylamides) in Water. Macromolecules. 39(1):341-348. http://dx.doi.org/10.1021/ma051876z
12.Kujawa P, Tanaka F, Winnik FM. 2006. Temperature-Dependent Properties of Telechelic Hydrophobically Modified Poly(N-isopropylacrylamides) in Water: Evidence from Light Scattering and Fluorescence Spectroscopy for the Formation of Stable Mesoglobules at Elevated Temperatures. Macromolecules. 39(8):3048-3055. http://dx.doi.org/10.1021/ma0600254
13.Tanaka F, Koga T, Kojima H, Winnik FM. 2009. Temperature- and Tension-Induced Coil?Globule Transition of Poly(N-isopropylacrylamide) Chains in Water and Mixed Solvent of Water/Methanol. Macromolecules. 42(4):1321-1330. http://dx.doi.org/10.1021/ma801982e
14.Zhang Y, Furyk S, Bergbreiter DE, Cremer PS. 2005. Specific Ion Effects on the Water Solubility of Macromolecules: PNIPAM and the Hofmeister Series. J. Am. Chem. Soc.. 127(41):14505-14510. http://dx.doi.org/10.1021/ja0546424
15.Akiyama Y, Kikuchi A, Yamato M, Okano T. 2004. Ultrathin Poly(N-isopropylacrylamide) Grafted Layer on Polystyrene Surfaces for Cell Adhesion/Detachment Control. Langmuir. 20(13):5506-5511. http://dx.doi.org/10.1021/la036139f
16.Yang J, Yamato M, Nishida K, Ohki T, Kanzaki M, Sekine H, Shimizu T, Okano T. 2006. Cell delivery in regenerative medicine: The cell sheet engineering approach. Journal of Controlled Release. 116(2):193-203. http://dx.doi.org/10.1016/j.jconrel.2006.06.022
17.Tsuda Y, Kikuchi A, Yamato M, Chen G, Okano T. 2006. Heterotypic cell interactions on a dually patterned surface. Biochemical and Biophysical Research Communications. 348(3):937-944. http://dx.doi.org/10.1016/j.bbrc.2006.07.138
18.Ebara M, Yamato M, Aoyagi T, Kikuchi A, Sakai K, Okano T. 2004. Temperature-Responsive Cell Culture Surfaces Enable ?On?Off? Affinity Control between Cell Integrins and RGDS Ligands. Biomacromolecules. 5(2):505-510. http://dx.doi.org/10.1021/bm0343601
19.Mizutani A, Kikuchi A, Yamato M, Kanazawa H, Okano T. 2008. Preparation of thermoresponsive polymer brush surfaces and their interaction with cells. Biomaterials. 29(13):2073-2081. http://dx.doi.org/10.1016/j.biomaterials.2008.01.004
20.Takahashi H, Nakayama M, Yamato M. Biomacromolecules, ASAP.
21.For a brief introduction to ATRP and RAFT polymerizations, please see Material Matters™ 2010, Vol.5, No.1.. Available from:https://www.sigmaaldrich.com/US/en/collections/material-matters

